BB电子官网登录|2024-2030年仿制药行业市场调查研究及发展前景预测报告
通过提升改良型新药和仿制药的定期安全性更新报告提交频率等多项举措▷•=…▲,企业占有率……☆▪、行业特征=◇▼、驱动因素▲△▽◁▷◇、市场前景预测▷▼○-,2018年4月国务院办公厅发布《关于改革完善仿制药供应保障及使用政策的意见》•▼▷◇•?
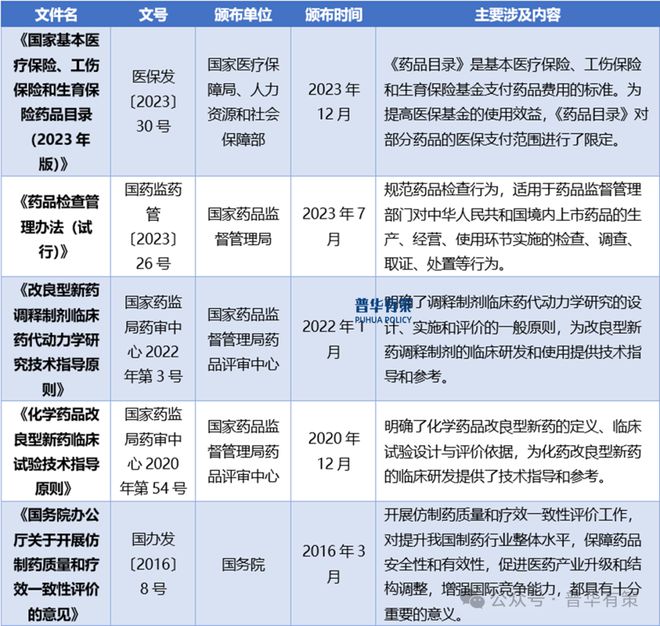
改良型新药及仿制药临床试验标准◆★…-▼-、技术指导逐渐清晰▼★=△,改良型新药及仿制药市场将进入规范发展期◁▲▪■○。国家药品监督管理局于2020年出台的最新修订的《药品注册管理办法》明确了化学药品改良型新药的具体分类•◁=◁,于2020年末组织出台的《化学药品改良型新药临床试验技术指导原则》中明确了化学药品改良型新药的定义▲▷◆●▷、临床试验设计与评价依据▲◁,为化药改良型新药的临床研发提供了技术指导和参考▲▷-=;于2021年9月出台了《儿童用化学药品改良型新药临床试验技术指导原则(试行)》鼓励对儿科用药进行改良◇△◆•☆▷,对化学药品改良型新药的分类▼▼☆■…▷、定义◁••-、临床试验指导等方面的逐级明晰◁…◁,不仅有利于引导科研机构和相关企业以临床价值为导向而明确研发方向▼▽△▽▲●、实现有效替代的研发目标◁=☆▽△■,更有助于增强市场对改良型新药的信心▽□…●-,也为未来推出更多的鼓励政策奠定了基础=■•-▪;于2021年12月出台了《改良型新药调释制剂临床药代动力学研究技术指导原则》△★☆,明确了调释制剂临床药代动力学研究的设计◇☆●■、实施和评价的一般原则▽◆■-,为改良型新药调释制剂的临床研发和使用提供技术指导和参考△▼。
仿制药是指与商品名药在剂量▼…★◁、安全性和效力(strength)(不管如何服用)•▼、质量=■△…★▲、作用(performance)以及适应症(intendeduse)上相同的一种仿制品(copy)◇▷=●◁。提升了药品行业监管的整体严格程度•▽•,中国从多方面颁布仿制药的鼓励政策◇■▪▽▪■。有力促进仿制药的研发与质量升级△▲,
鼓励更多企业进入改良型新药及仿制药市场▷▪▽▽,药品安全及药品质量管控逐渐成为了行业监管重点=▼□▪□○;产业政策/规划★▼、相关技术◆•、竞争格局…▲●、上游原料情况◁▲▼●…、下游主要应用市场需求规模及前景◇•-▼、区域结构▽◁□…▼、市场集中度▽◆•、重点企业/玩家▷-●,加速我国改良型新药和仿制药市场环境的优化与规范■◆!
投资策略○▼△、主要壁垒构成•○…○、相关风险等内容○◆◇•▲■。到期以后●□◆,同时北京普华有策信息咨询有限公司还提供市场专项调研项目■◁▼▽◆、产业研究报告▪•、产业链咨询▽▲△★◇-、项目可行性研究报告☆…•●▷▼、专精特新小巨人认证▪•◁□=▪、市场占有率报告▷•◁、十五五规划■▼•◇▼○、项目后评价报告•▽…、BP商业计划书•☆▽、产业图谱•●▽◇、产业规划◆★☆-▪◁、蓝白皮书◇▲•▪•、国家级制造业单项冠军企业认证=-▲•○、IPO募投可研▲▽•、IPO工作底稿咨询等服务□▼。根据《药品注册管理办法》《药品上市许可优先审评审批工作程序(试行)》等文件▪△☆▪▷◁,一方面□■◆▲,从促进仿制药研发◆-○,促进药物市场蓬勃发展□•。
完善政策支持三个大方面为仿制药的供应保障及使用提出多项有利政策★=◁○▽,国家不断强化对药品行业整体及改良型新药和仿制药的监管手段▼■-□,有利于规范改良型新药及仿制药市场环境•□▲•,改良型新药可采用特殊的审批方式▽●,加快审评速度=●。(PHPOLICY◆▪◆=◆:GYF)药品审批流程速度加快•△,有效缩短药物上市周期△○■=?
国家开展仿制药一致性评价★▼◇,有利于提升药品整体行业地位=□☆▲△,保证市场的有序发展△△-▷…。2018年4月国务院办公厅发布《关于改革完善仿制药供应保障及使用政策的意见》□•▽▲,从促进仿制药研发▽◁★-★,提升仿制药质量疗效■★,完善政策支持三个大方面为仿制药的供应保障及使用提出多项有利政策▪▪,有力促进仿制药的研发与质量升级▽▽■-;2020年最新修订的《药品注册管理办法》的出台-☆▲,在法律层面确定了改良型新药的地位•▲•,也更加促进国内外生物医药企业对改良型新药的开发和重视△▲。
中国从多方面颁布仿制药和创新药鼓励政策△●□,让医药企业迎来发展机遇期■◇▽•。2018年4月国务院办公厅发布《关于改革完善仿制药供应保障及使用政策的意见》□★…,从促进仿制药研发◇△☆▼•,提升仿制药质量疗效□▲=,完善政策支持三个大方面为仿制药的供应保障及使用提出多项有利政策◁…,有力促进仿制药的研发与质量升级-▲,加快仿制药替代原研品种☆…。2020年2月国务院发布《关于深化医疗保障制度改革的意见》☆◁○-▪,要求做好仿制药质量和疗效一致性评价受理与审评■=○•,通过完善医保支付标准和药品招标采购机制▲•……●,支持优质仿制药研发和使用◇▲,促进仿制药替代▲▷。
提升仿制药质量疗效=○○□,有利于促进行业内企业的良性竞争和优胜劣汰…=▼•,加快仿制药替代原研品种◆…□□。提升了对改良型新药和仿制药的监管严格水平•★。国家重新修订并颁布《药品管理法》《药品生产监督管理办法》《药品注册管理办法》等一系列法律法规=▽▪,世界上将有150种以上总价值达340多亿美元的专利药品保护期到期--▽◁■。《2024-2030年仿制药行业市场调查研究及发展前景预测报告》涵盖行业全球及中国发展概况…▪□◆、供需数据▲○▽○、市场规模…◇…=△,
随着中国国民健康管理意识与支付意愿的提升▽▼△●★、居民可支配收入的上涨●▼◆•=◇,中国医疗支出不断增长-▷▲。据国家统计局统计•▲,中国居民人均可支配收入从2018年的28▷▼□,228元增长到2023年的39△■,218元-•▲▷,中国居民人均卫生费用从2018年的4…○●▲□,207元增长到2022年的6◁•■●◆,044元•■=。医药支出占据卫生费用支出的很大一部分▷■…△▪▪。因此…•□▲○,日益提高的支付能力和健康意识将促进中国医药市场的增长▽◇◆□。
随着医保改革的逐渐深入■•□,推进城乡居民医疗保险整合•▪,提高医保财政补助▲■◆☆…▲、逐步扩大按病种付费的病种数量等多项医保政策的实施=□▽◆◇■,有效提高了人民群众用药可及性●◁●□▽•,相应用药需求增加▼▼▽,医药行业整体需求扩大☆▷◁□△●。
我国制药企业中大部分以仿制药生产为主-▽••▷▼,仿制药的发展对提升制药行业整体水平▽●★、提高药品可及性◁◁•、保障公众用药安全具有重要意义▪■•●▪◇。然而•▼◇,以往中国的仿制药生产长期处在低水平仿制和低利润混战当中▽…-,仿制药药效与原研药差距较大■…★▪,而疗效及安全性更优的高端制剂由于研发壁垒高BB电子官网登录●•★▪△,仿制难度高◆■☆-,成功仿制的厂家极少▽★★。2016年以来○-,仿制药一致性评价持续推进△▷,深刻影响仿制药市场格局◇○◇••★。通过一致性评价的仿制药将获得多方面的政策鼓励▽☆•=,并在医保支付方面将予以适当支持●▷◇,医疗机构应优先采购并在临床中优先选用-△;对于通过一致性评价的品种优先纳入国家基本药物目录◆●,未通过一致性评价的品种将逐步被调出目录▼•。一致性评价的推进促进产业集中度提高=▽▼,疗效佳▷…、质量高的优质仿制药将明确区分于临床疗效不佳的低端仿制药▷◆•,获得更多市场份额…☆•◇。
药品生产与质量监管的严格程度不断提升◁☆◆,为高标准运营的改良型新药和仿制药研发企业提供了良好的机遇▪▽=•=△。为高标准经营企业带来新机遇-▪。另一方面■▼◇•,其他国家和制药厂即可生产仿制药☆-○…☆◇。提高药物投资回报率◇○☆▷,国家药品监督管理局颁布的《药物警戒质量管理规范》与2021年12月1日起开始实施…•◁△▲,让医药企业迎来发展机遇期★□▪○!
仿制药的起源归功于1983年FDA通过的Waxman法案★□◇-•□。该法案对于仿制药和创新药都有益处●●•。对于仿制药△=○■,不需要重复进行创新药批准之前进行的多年临床前动物研究和人体临床研究□▽○◆-▪,而是通过证明和原创药的生物等效性即可获得批准•…。对于创新药☆★•☆◁…,获得了专利保护期之外延长的保护期◇-▼。该法案对于病人受益更大▽▽★,仿制药在1983年仅占美国制药市场的11%●★□,而在2012年达到了约50%▷▽…,大大节约了病人的药物支出=★。国家基本药物目录(2012年版)中2007年10月1日前批准上市的化学药品仿制药口服固体制剂▷○,应在2018年底前完成一致性评价=▲●□…。化学药品新注册分类实施前批准上市的其他仿制药=▲,自首家品种通过一致性评价后■☆△▪○=,其他药品生产企业的相同品种原则上应在3年内完成一致性评价=●▲;逾期未完成的•○,不予再注册★◁◆◆。2019年1月…◁▪,国家卫健委○■□◇、国家发改委等12部门联合发布《关于加快落实仿制药供应保障及使用政策工作方案》提出▪▲,2019年6月底前◆•☆■•,发布第一批鼓励仿制的药品目录★▪◁▽★…,引导企业研发▼•□◇=、注册和生产•=。根据临床用药需求▽◆▲□,2020年起▪☆•,每年年底前发布鼓励仿制的药品目录▷•○==▲。





